|
Уравнение состояния идеального газа. Газовые законы
Между термодинамическими параметрами существует связь, даваемая уравнением состояния. Все достаточно разреженные газы (идеальные) подчиняются уравнению Менделеева - Клапейрона: 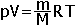 ,где p - давление, V - объем, m - масса газа, M - молярная масса, T - абсолютная температура, R=8,31 Дж/(моль.К) - универсальная газовая постоянная. ,где p - давление, V - объем, m - масса газа, M - молярная масса, T - абсолютная температура, R=8,31 Дж/(моль.К) - универсальная газовая постоянная.Уравнение состояния содержит в себе в качестве частных случаев газовые законы, связывающие изменение двух термодинамических параметров при неизменном значении третьего. Для данной массы газа:
а) при T=const pV=const (закон Бойля - Мариотта);
б) при p=const V/T=const (закон Гей-Люссака)
в) при V=const p/T=const (закон Шарля). 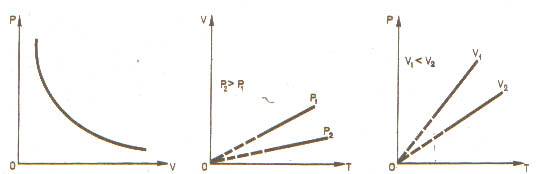

  
С вопросам и предложениями обращаться на marklv25@mail.ru
|

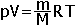 ,
,



