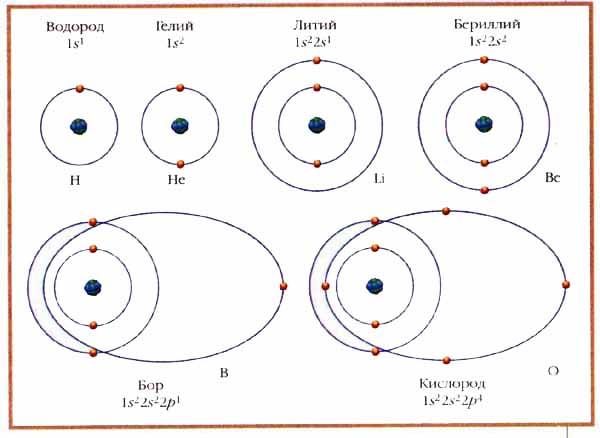
Электронный слой атома образуют электроны с одинаковой энергией, т. е. с одинаковым n во всех состояниях. Учитывая возможные значения квантовых чисел l, m и ms, можно подсчитать, что в каждом слое имеется 2n2 состояний. В самом нижнем, с минимальной энергией (где n=1), всего 2 состояния, в следующем (где n=2) их 8, затем 18, 32 и т. д. Слои подразделяют на оболочки, в которых электроны имеют одинаковую величину орбитального момента; оболочка с определёнными n и l включает 2(2l+1) электронных состояний. Например, в 2-электронном слое лишь 1 оболочка; в 8-электронном - 2 оболочки из 2 и 6 состояний; в 18-электронном - 3 оболочки из 2, 6 и 10 состояний и т. д.
Первые два электрона заполняют самый нижний (по уровню энергии) слой с n=1 - I период таблицы Менделеева, с двумя элементами. Потом электроны идут в следующий слой (n=2), заполнив сначала оболочку с l=0 (круговые орбиты), а затем с l=1 (вытянутые орбиты) - II период, с восемью элементами. Уже в III периоде дело усложняется: в многоэлектронном атоме электрон взаимодействует с другими электронами и магнитным полем ядра атома. В результате может оказаться, что состояние с большим n имеет меньшую энергию, а потому заполняется раньше. Так и происходит, начиная со слоя с n=3. В нём заполняется прежде всего оболочка с l=0, затем оболочка с l=1, на чём III период и заканчивается. Четвёртый период начинается с заполнения оболочки с l=0 в слое с n=4, после чего вновь продолжается заполнение слоя с n=3, оболочки с l=2 и т. д., пока все слои не будут заполнены.