Атомные спектры и квантовая теория.
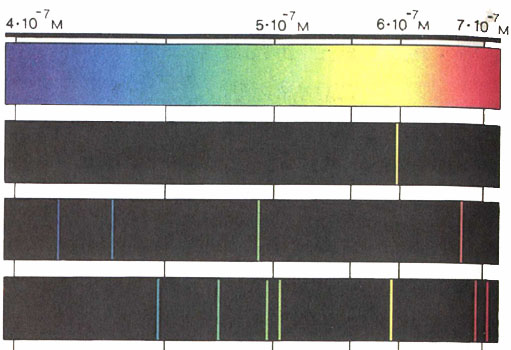
Третьим источником для квантовой теории послужили оптические спектры атомов. Ещё в начале XIX в. физики обнаружили, что при нагревании любое вещество излучает свет строго определённых длин волн. Разлагая такой свет с помощью спектроскопа, получают ряды спектральных линий - линейчатые спектры, индивидуальные для каждого элемента, входящего в это вещество.
Длина волны
Сплошной
Натрий
Водород
Гелий
В 1859 г. Густав Роберт Кирхгоф и Роберт Бунзен разработали метод спектрального анализа. Было установлено, что при нагревании атомы испускают световые волны характерной длины независимо от того, в составе какого вещества эти атомы находятся.
К началу XX в. был накоплен огромный спектроскопический материал. Но как его объяснить? Ведь согласно электродинамике, излучение происходит при неравномерном движении зарядов. Какие же движения зарядов в атоме вызывают излучение? Как должен быть устроен атом, чтобы его излучение имело наблюдаемый спектр?
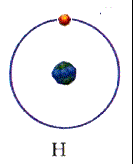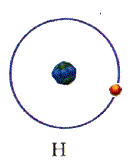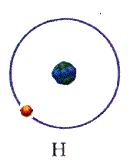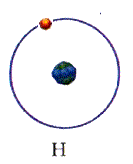
В 1911 г. Эрнест Резерфорд, исследуя рассеяние а-частиц на золотой фольге, обнаружил, что они отклоняются от первоначального направления на разные углы, а некоторые из них отклоняются на углы, большие 90 градусов, как будто на их пути встречался большой положительный заряд, сконцентрированный в очень малой области пространства. Резерфорд предположил, что атом похож на планетарную систему: положительный заряд сосредоточен в центре, а вокруг вращаются электроны. На основании модели он вывел закон рассеяния а-частиц атомами различных элементов - знаменитую формулу Резерфорда, которая полностью совпала с экспериментальными данными.
Спустя два года, в 1913 г., Нильс Бор, исходя из планетарной модели атома Резерфорда, попытался объяснить атомные спектры. Главная трудность состояла в том, что в соответствии с законами электродинамики электрон, вращаясь вокруг положительно заряженного ядра, должен был за триллионные доли секунды потерять энергию вращения и упасть на ядро, чем всё и закончилось бы. Бор допустил, что электрон в атоме может находиться только на определённых - так называемых стационарных уровнях, или оболочках, где излучения не происходит. Но при переходе электрона с орбиты, на которой он имеет высокую энергию, на другую, с более низкой энергией, излучается фотон. Его частоту можно вычислить с помощью формулы Планка:
где h - постоянная Планка, v - частота фотона, Ei и Ej - энергия на исходной и конечной орбите соответственно.
Для определения стационарных орбит Нильс Бор воспользовался принципом соответствия, который сам и выдвинул. В данном случае принцип соответствия звучит так: когда частоты излучения очень малы, а длины волн велики, формулы квантовой физики близки к формулам классической.
Так Бору удалось объяснить весь спектр излучения водорода. Энергия электрона на стационарных орбитах в атоме водорода определяется по формуле:
где h - постоянная Планка, c - скорость света, En - энергия электрона, R - спектроскопическая постоянная Ридберга, n - главное квантовое число, принимающее только целые значения.
Вычисленный по этой формуле радиус стационарной орбиты равен экспериментальным данным.
Так завершилось создание того, что позднее стали называть "старой" или полуклассической квантовой теорией. Были разрушены устои классической физики. Но для расчётов "старая" теория имела лишь один инструмент - принцип соответствия. Требовались свежие идеи и строгая теория, которая позволила бы получать достоверные данные путём прямых расчётов. Позднее такая теория была названа "новой" квантовой теорией.